தாதுக்களின் தோற்றம், இயற்பண்புகள், வேதிப்பண்புகள், பயன்கள் - தாமிரத்தின் உலோகவியல் | 10th Science : Chapter 8 : Periodic Classification of Elements
10வது அறிவியல் : அலகு 8 : தனிமங்களின் ஆவர்த்தன வகைப்பாடு
தாமிரத்தின் உலோகவியல்
தாமிரத்தின்
உலோகவியல்
ரோமானியர்களால், இவ்வுலோகம் குப்ரம்
என்றழைக்கப்பட்டது. ஏனெனில் சைப்ரஸ் என்னும் தீவிலிருந்து எடுக்கப்பட்டதால்
அவ்வாறு அழைக்கப்பட்டது. இது தனித்தும், சேர்ந்தும்
காணப்படும்.

காப்பரின் முக்கிய தாது காப்பர்
பைரைட் ஆகும். 76 சதவீதம் தாமிரம் இத்தாதுவில் இருந்து பெறப்படுக்கின்றது. தாமிரம்
பிரித்தெடுத்தல் கீழ்கண்டபடிகளில் நடைபெறுகிறது.
1. தாதுவைச்
செறிவூட்டல்:
தூளாக்கப்பட்ட தாதுவானது, நுரைமிதப்பு முறையில் செறிவூட்டம் செய்யப்படுகிறது.
2. வறுத்தெடுத்தல்: அடர்ப்பிக்கப்பட்ட தாதுவானது, ஆக்ஸிஜன்
முன்னிலையில் வறுக்கப்படுகின்றது. அதனால் ஈரம் மற்றும் ஆவியாகும் மாசுக்களும்
நீக்கப்படுகின்றன. சல்பர், பரஸ்பரஸ், ஆர்சனிக்
மற்றும் ஆண்டிமனி போன்றவை ஆக்சைடுகளாக மாறி நீக்கப்படுகின்றன காப்பர் பைரைட்டானது,
காப்பர், இரும்பு சல்பைடுகளாக பகுதியளவு
மாறுகிறது.
2CuFeS2 + O2 →
Cu2S + 2 FeS + SO2 ↑
3. உருக்கிப்பிரித்தல்: வறுக்கப்பட்ட தாதுவானது தூளாக்கப்பட்ட
கார்பன் மற்றும் மணலுடன் கலந்து சூடேற்றும் போது மாட்டியும், (Cu2S + FeS) கசடும் உருவாகும். கசடை நீக்க வேண்டும்.
4. பெஸ்ஸிமராக்குதல்: உருகிய பெஸ்ஸிமர் மாற்று
உலையிலிட்டு சூடேற்றும் போது கொப்புளக் காப்பர் உருவாகும். மாட்டியில் உள்ள
இரும்பு சல்பைடு ஆக்ஸிஜனேற்றம் அடைந்து இரும்பு ஆக்சைடாக மாறுகிறது. இவை
சிலிகாவுடன் சேர்ந்து கசடாக மாறும்.
2 FeS + 3 O2 → 2 FeO + 2 SO2 ↑
FeO + SiO2 → FeSiO3 (கசடு) (இரும்பு சிலிகேட்)
2 Cu2S + 3O2 → 2 Cu2O
+ 2 SO2 ↑
2 Cu2O + Cu2S → 6 Cu + SO2↑ (கொப்புள காப்பர்)
5. தூய்மையாக்கல்: 98% காப்பரும், 2%
மாசுக்களும் உள்ள கொப்புளக் காப்பரை மின்னாற்பகுத்தல் செய்வதன் மூலம் மிகத்
தூய்மையான உலோகம் பெறலாம்.
மின்னாற்பகுத்தல்
முறையில் தூய்மை
எதிர்மின்வாய்: தூய மெல்லிய காப்பர் தகடு
நேர்மின்வாய் : மாசு கலந்த காப்பர் மின்பகுளி :
கந்தக அமிலம் கலந்த காப்பர் சல்பேட் மின்பகுளியின் வழியாக மின்சாரத்தைச்
செலுத்தும்போது தூய காப்பர் எதிர்மின் முனையிலும், மாசுக்கள் நேர்மின் முனையிலும் படிகின்றன.
நேர்மின் வாயின் அடியில் படியும் மாசுக்கள் ஆனோடு மண் எனப்படும்.
தாமிரத்தின்
இயற்பண்புகள்:
இது செம்பழுப்பு நிறமுள்ள உலோகம்
ஆகும். பளபளப்பும், அதிக அடர்த்தியும் கொண்டது. இதன் உருகுநிலை 1356°C.
தாமிரத்தின்
வேதிப்பண்புகள்:
1. காற்றுடனும்,
ஈரப்பதத்துடனும் வினை: தாமிரம் CO2 மற்றும் ஈரப்பதத்துடன் வினைபுரிந்து, பச்சை நிறக்
காப்பர் கார்பனேட் படலத்தை உருவாக்குகிறது.
2 Cu + O2 + CO2 +
H2O → CuCO3.Cu(OH)2
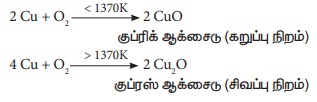
2. வெப்பத்துடன் வினை: வெவ்வேறு வெப்பநிலைகளில், தாமிரம், ஆக்ஸிஜனுடன்,
வினைபுரிந்து இருவேறு ஆக்சைடுகளை உருவாக்கும். CuO, Cu2O.
3. அமிலங்களுடன் வினை:
அ. நீர்த்த HCl மற்றும் H2SO4
உடன் வினை
காற்றில்லா சூழ்நிலையில், நீர்த்த HCI
மற்றும் H2SO4 அமிலங்களுடன்
வினை புரியாது. ஆனால் காற்றின் முன்னிலையில் அமிலத்தில் கரைகின்றது.
2 Cu + 4 HCl + O2 (காற்று) →2 CuCl2 + 2 H2O
Cu + 2 H2SO4 → CuSO4 +
SO2 ↑ + 2 H2O
ஆ. நீர்த்த HNO3 உடன்
வினை:
நீர்த்த HNO3 உடன்
வினைபுரிந்து நைட்ரிக் ஆக்ஸைடு வாயுவை வெளியேற்றுகின்றது.
3 Cu + 8 HNO3 → Cu(NO3)2 +
2 NO ↑ + 2H2O
4. குளோரினுடன் வினை:
தாமிரம், குளோரினுடன்
வினைபுரிந்து காப்பர் (II) குளோரைடை தருகின்றது.
Cu + Cl2 → CuCl2
5. காரத்துடன் வினை:
தாமிரம் காரத்தினால் எந்த
பாதிப்பும் அடைவதில்லை.
பயன்கள்
• மின்கம்பிகளையும், மின்
உபகரணங்களையும் உருவாக்கப் பயன்படுகிறது.
• கலோரிமீட்டர், பாத்திரங்கள்,
நாணயங்கள் போன்றவற்றை உருவாக்கப் பயன்படுகிறது.
• மின்முலாம் பூசப் பயன்படுகிறது.
• தங்கம் மற்றும் வெள்ளியோடு கலந்து, உலோகக்கலவையாக்கி
நாணயங்கள் மற்றும் அணிகலன்கள் உருவாக்கப் பயன்படுகிறது.