வகைகள், பண்புகள், பயன்கள், அடையாளம் காணுதல் - உப்புகள் | 9th Science : Acids, Bases and Salts
9th Science : Acids, Bases and Salts
உப்புகள்
உப்புகள்
உப்பு என்றாலே சாதாரண உப்பு உங்கள் நினைவிற்கு வரலாம். கடல் நீரில் பல வகையான உப்புகள் கரைந்துள்ளன. அவற்றிலிருந்து சோடியம் குளோரைடு பிரித்தெடுக்கப்படுகிறது. இவை பல வகைகளில் பயன்படுகின்றன. அனைத்து உப்புகளும் அயனிகளின் சேர்மமாகும். அமிலங்களுக்கும்,
காரங்களுக்குமிடையே நிகழும் நடுநிலையாக்கும் வினையின் மூலம் கிடைக்கும் விளை பொருள்களே உப்புகளாகும். இவை நீரில் கரைந்து நேர் மற்றும் எதிர் அயனிகளை உருவாக்குகின்றன.
அமிலம் +
காரம் →
உப்பு +
நீர்

1. உப்புகளின் வகைகள்
சாதாரண உப்புகள்: ஓர் அமிலம் மற்றும் காரம் இவற்றின் முழுமையான நடுநிலையாக்கலின் போது சாதாரண உப்பு கிடைக்கிறது.
NaOH
+ HCI → NaCl + H2O
அமில உப்புகள்: ஓர் உலோகமானது அமிலத்திலுள்ள ஹைட்ரஜன் அணுக்களின் பகுதியளவை வெளியேற்றுவதால் இவை உருவாகின்றன. பல காரத்துவ அமிலத்தை ஒரு காரத்தினால் பகுதியளவு நடுநிலையாக்கி இவை பெறப்படுகின்றன.
NaOH
+ H2SO4 → NaHSO4 + H2O
கார உப்புகள்: இவை இரு அமிலத்துவ அல்லது மூன்று அமிலத்துவக் காரங்களிலுள்ள ஹைட்ராக்சைடு அயனிகளைர் அமிலத்தால்பகுதியளவு வெளியேறச் செய்து பெறப்படுகின்றன.
Pb(OH)
2 + HCl → Pb(OH)Cl + H2O
இரட்டை உப்புகள்: சமமான மூலக்கூறு எடைவிகித அளவுகளில் இரண்டு எளிய உப்புகளின் நிறைவுற்ற கரைசல்களைச் சேர்த்து படிகமாக்கும் போது இரட்டை உப்புகள் உருவாகின்றன. உதாரணமாக, பொட்டாஷ் படிகாரம் என்பது பொட்டாசியம் சல்பேட் மற்றும் அலுமினியம் சல்பேட் கலந்த கலவையாகும்.
KAl(SO4)2
12H2O
2. உப்புகளின் பண்புகள்
● உப்புகள் பெரும்பாலும் திடப்பொருள்களாகும். அதிக வெப்பநிலையில் உருகவும்,
கொதிக்கவும் செய்கின்றன.
● பெரும்பாலான உப்புகள் நீரில் கரையும். எ.கா: சோடியம் குளோரைடு,
பொட்டாசியம் குளோரைடு. ஆனால் சில்வர் குளோரைடு நீரில் கரையாது.
● நிறமற்றது. வெண்மையானது,
கன சதுர படிகம் அல்லது படிகத் தூளாக இருக்கும்.
. நீரை உறிஞ்சும் தன்மையுடையது.
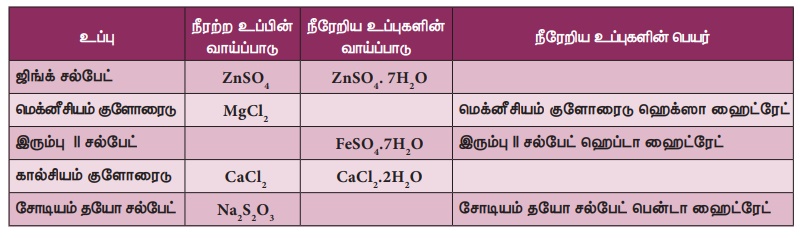
3. படிக நீர்
பல உப்புகள் நீர் மூலக்கூறுகளுடன் இணைந்து படிகமாகக் காணப்படுகின்றன. இந்த நீர் மூலக்கூறுகள் படிக நீர் எனப்படும். படிக நீரைக் கொண்ட உப்புகள் நீரேற்ற உப்புகள் எனப்படும். உப்புடன் இணைந்து நீரேற்றம் கொண்ட நீர் மூலக்கூறுகளை வேதி வாய்பாட்டிற்குப் பின் ஒரு புள்ளி வைத்து அதன் அளவு குறிப்பிடப்படும். எ.கா காப்பர் சல்பேட் என்ற உப்பில் ஐந்து நீர் மூலக்கூறுகள் உள்ளன. அதனை இவ்வாறு எழுதலாம்: CuSO.5H,O. இதனை காப்பர் சல்பேட் பென்டாஹைட்ரேட் என அழைக்கலாம். இந்த படிக நீர் காப்பர் சல்பேட்டை நீல நிறமாக மாற்றும். இதனைவெப்பப்படுத்தும் போது நீர் மூலக்கூறுகளை இழந்து வெண்மையாக மாறும்.

படிகநீர் உப்பு படிக நீர் அற்ற உப்புகள் நீரேற்றம் அற்ற உப்புகள் எனப்படும். இவை தூளாகக் காணப்படும்.
செயல்பாடு 4
படிகநீர் கருத்தை அடிப்படையாகக் கொண்டு கீழ்க்கண்ட அட்டவணையை
நிரப்புக.
4. உப்பை அடையாளம் காணுதல்
i.
இயற் சோதனைகள்: உப்புகளின் நிறம், மணம் மற்றும் அடர்த்தி ஆகியவற்றை அறிதல். இந்த சோதனை நம்பகத்தன்மை அற்றது.
ii.
உலர் வெப்ப சோதனை: உலர்ந்த சோதனைக் குழாயில் சிறிதளவு உப்பை எடுத்துக்கொண்டு சூடுபடுத்தவும். நீர் ஆவியான பிறகு,
கரையாத உப்புகள் சோதனைக் குழாயின் அடியில் தங்கும்.
iii.
சுடர் சோதனை : சில உப்புகள் அடர் ஹைட்ரோகுளோரிக் அமிலத்துடன் வினைபுரிந்து அவற்றின் குளோரைடுகளைத் தருகின்றன. அடர் ஹைட்ரோகுளோரிக் அமிலத்துடன் கலந்த கலவை பிளாட்டினம் கம்பியின் உதவியோடுசுடரில்காட்டப்படுகிறது.

5. உப்புகளின் பயன்கள்
சாதாரண உப்பு -
சோடியம் குளோரைடு (NaCl)
இது நம் அன்றாட உணவிலும், உணவைப் பாதுகாப்பதிலும் பயன்படுகிறது.
சலவை சோடா -
சோடியம் கார்பனேட் (Na2CO3)
i.
இது கடின நீரை மென்னீராக்கப் பயன்படுகிறது.
ii. இது கண்ணாடித் தொழிற்சாலை, சோப்பு மற்றும் பேப்பர் தொழிற்சாலைகளில் பயன்படுகிது.
சமையல் சோடா -
சோடியம் பை கார்பனேட் (NaHCO3)
i. இது ரொட்டிச் சோடா தயாரிக்கப் பயன்படுகிறது. ரொட்டிச் சோடா என்பது சமையல் சோடாவும்,
டார்டாரிக் அமிலமும் சேர்ந்த கலவையாகும்.
ii.
இது சோடா -
அமில தீயணைப்பான்களில் பயன்படுகிறது.
iii.
கேக் மற்றும் ரொட்டிகளை மென்மையாக மாற்றுகிறது.
iv.
இது அமில நீக்கியில் உள்ள ஒரு பகுதிப்பொருள் இந்தக் கரைசல் காரத் தன்மை பெற்றிருப்பதால் வயிற்றிலுள்ள அதிகப்படியான அமிலத்தை நடுநிலையாக்குகிறது.
சலவைத் தூள் -
கால்சியம் ஆக்ஸிகுளோரைடு (CaOCl2)
i.
கிருமி நாசினியாகப் பயன்படுகிறது.
ii.
பருத்தி மற்றும் லினன் துணிகளை வெளுக்கப் பயன்படுகிறது.
பாரிஸ் சாந்து -
கால்சியம் சல்பேட் ஹெமிஹைட்ரேட் (CaSO4 1/2SH2O)
i. முறிந்த எலும்புகளை ஒட்ட வைப்பதற்குப் பயன்படுகிறது.
ii.
சிலைகளுக்கான வார்ப்புகளைச் செய்யப் பயன்படுகிறது.
செயல்பாடு 5
100 மிலி சாதாரண நீரை ஒரு பாத்திரத்தில் கொதிக்க வைக்கவும். அனைத்து நீரும், நீராவியான பிறகு, அந்த பாத்திரத்தின் உட்பகுதியைக் கவனிக்கவும். ஏதேனும் பாத்திரத்தில் படிந்துள்ளதா? நீரில் கரைந்துள்ள உப்புகளால் இந்தப் படிவு ஏற்பட்டுள்ளது.
நினைவில் கொள்க
❖ நீரில் கரையும் பொழுது H+
அயனிகளையோ, H3O+ அயனிகளையோ தரும் பொருள்களை அமிலங்கள் என்கிறோம்.
❖ நீரில் கரைந்து OH-
அயனிகளைத் தருபவை காரங்கள் எனப்படுகின்றன.
❖ அமிலங்களுக்கும், காரங்களுக்குமிடையே நிகழும் நடுநிலையாக்கும் வினையின் மூலம் கிடைக்கும் விளைபொருள்களே உப்புகளாகும்.
❖ நமது அன்றாட வாழ்க்கையிலும், தொழிற்சாலைகளிலும் உப்பு பல்வேறு விதங்களில் பயன்படுகிறது.
❖ அமிலங்கள் மற்றும் காரங்கள் நீரில் கரைந்து அயனிகளைத் தந்து மின்சாரத்தைக் கடத்தும்.
❖ அமிலங்கள் உலோகங்களுடன் வினைபுரிந்து அவற்றின் உப்பையும், நீரையும் தருகின்றன.
❖ ஒரு கரைசல் அமிலமா, காரமா என அறிவதற்கு நிறங்காட்டிகளான பினாப்தலீன் மற்றும் மெத்தில் ஆரஞ்சு பயன்படுத்தப்படுகின்றன. லிட்மஸ் தாளும் பயன்படுத்தப்படுகிறது.
❖ கொடுக்கப்பட்டுள்ள கரைசல் அமிலத்தன்மை வாய்ந்ததா?
அல்லது காரத்தன்மை வாய்ந்ததா? எனக் கண்டறிய pH
தாள் பயன்படுத்தப்படுகிறது.
❖ இராஜ திராவகம் என்பது மூன்று பங்கு ஹைட்ரோ குளோரிக் அமிலமும், ஒரு பங்கு நைட்ரிக் அமிலமும் கலந்த கலவையாகும்.
❖ pH அளவீடு கரைசலில் உள்ள ஹைட்ரஜன் அயனிகளின் செறிவினைக் கண்டுபிடிக்கப் பயன்படுகிறது.
A-Z சொல்லடைவு
அமிலங்கள் : நீரில் கரையும் போது H+
அயனிகளையோ H3O+
அயனிகளையோ தரும் பொருள்கள்.
காரங்கள் : நீரில் கரைந்து ஹைட்ராக்சைடு அயனிகளைத் தரும் பொருள்கள்.
உப்புகள் : அமிலங்களுக்கும், காரங்களுக்கும் இடையே நிகழும் வினையின் போது கிடைக்கும் நடுநிலை வினை விளைபொருள்கள்.
நிறங்காட்டிகள் : கொடுக்கப்பட்டுள்ள கரைசல் அமிலமா (அ) காரமா எனக் கண்டறிய உதவும் பொருள்கள்.
pH அளவீடு : கரைசலில் உள்ள ஹைட்ரஜன் அயனிகளின் செறிவைக் கண்டறிய உதவும் அளவீடு.
pH தாள் : கொடுக்கப்பட்டுள்ள கரைசல் அமிலத் தன்மை, காரத் தன்மை மற்றும் நடுநிலைத் தன்மை வாய்ந்ததா எனக் கண்டறிய உதவும் தாள்.
இராஜதிராவகம் : அக்குவாரீஜியா எனப்படும் இராஜதிராவகம் மூன்று பங்கு ஹைட்ரோ குளோரிக் அமிலமும் ஒரு பங்கு நைட்ரிக் அமிலமும் கலந்த கலவையாகும்.
ஹைக்ராஸ்கோபிக் : நீரை ஈர்க்கும் தன்மையுடைய பொருள்.